Descrizione
Elettrocardiografo Edan SE-1201
- Display LCD TFT touch screen (OPZIONALE) a colori da 7 pollici
- Tastiera alfanumerica
- 200 ECG nella memoria interna con supporto per i dischi flash USB
- Stampa su carta A4 a pacchetto
- Stampa estesa e su aritmia
- Misure automatiche e interpretazione Glasgow
- Memoria di 120s ECG in tempo reale delle forme d’onda ,congelamento e revisione
- Analisi Variabilità della frequenza cardiaca (HRV)
- Capacità di esportazione dei dati PDF, SCP e FDA-XML
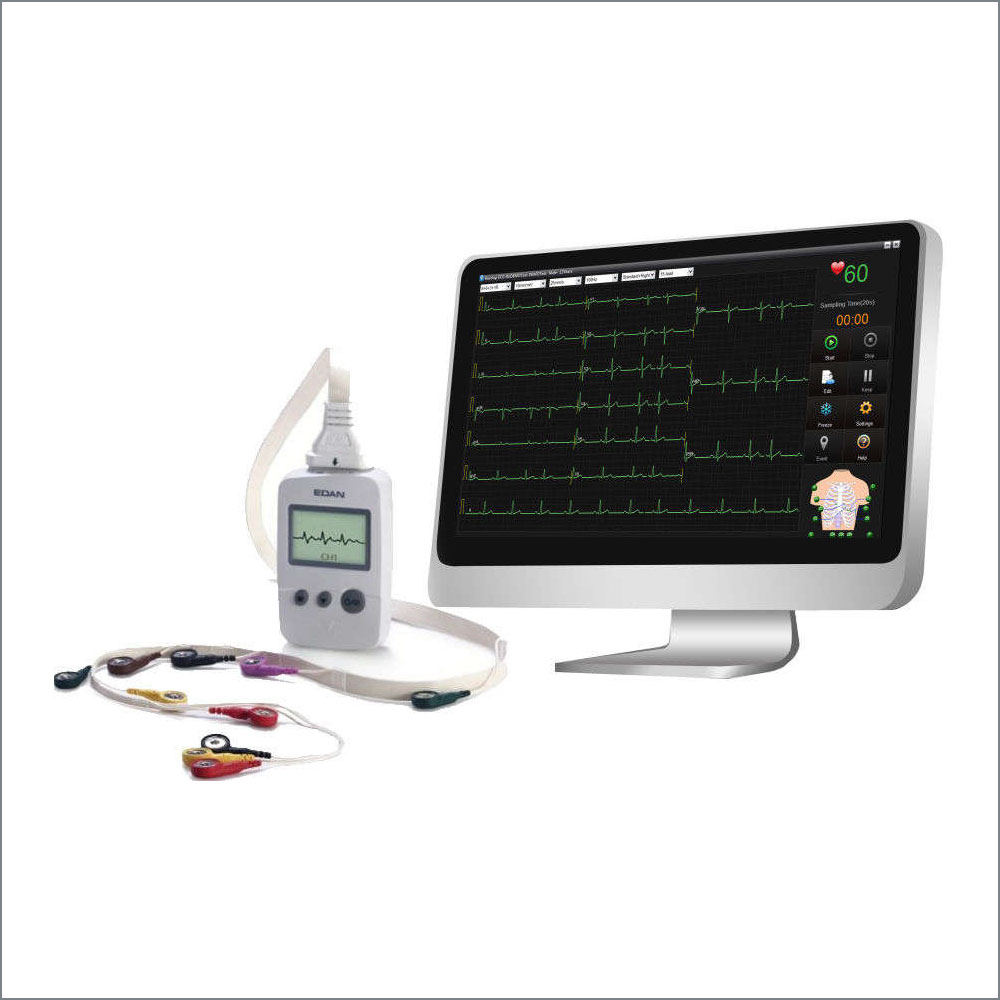
- Trasmissione dati al PC via LAN / WIFI
- Opzione: Software per la gestione dei dati ECG sul PC, collegamento fino a 10 elettrocardiografi, anche in modalità wireless ” Smart ECG Viewer”
ECG SE1201.pdf
DownloadQui puoi scaricare il PDF illustrativo di ECG SE1201