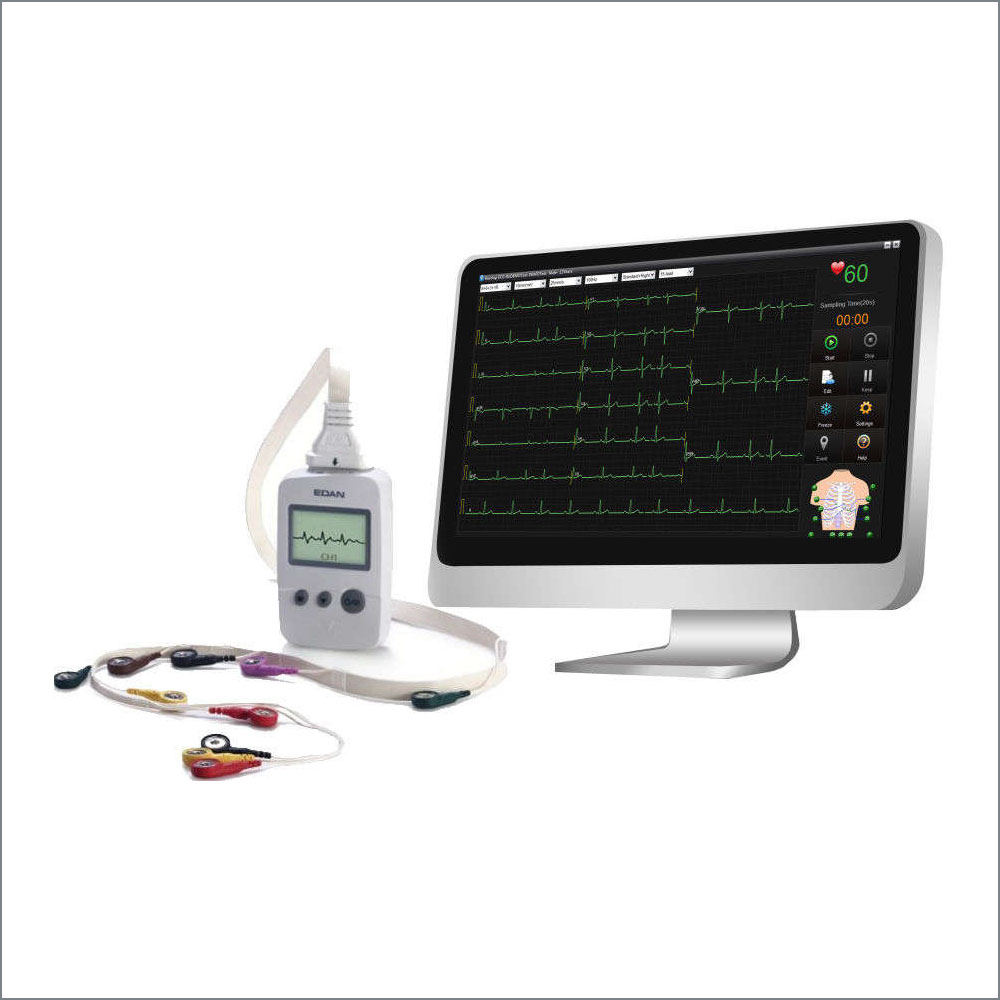
Descrizione
Elettrocardiografo Edan SE-301 3CH
- Modalità Manuale registrazione ininterrotta fino a 5 ore
- Modalità Auto registrazione fino a 500 referti
- Possibilità di stampa esterna tramite USB port
- Possibilità di connessione lettore codice a barre
- Possibile estensione memoria con USB flash disk e micro SD card
- Completo di filtri digitali
- Campionamento fino a 120 secondi
- Memoria 500 registrazioni, dati memorizzati trasferibili su PC (usare specifico software)
- Acquisizione contemporanea di 12 tracce
ECG SE301.pdf
DownloadQui puoi scaricare il PDF illustrativo di ECG SE301